概述
阿尔茨海默病是一种逐渐加重的脑部疾病。其特征是脑部变化导致某些蛋白质的沉积。阿尔茨海默病会导致脑缩小和脑细胞最终死亡。阿尔茨海默病是最常见的痴呆症病因,后者会导致记忆力、思想、行为和社会技能持续下降,这些变化会影响个人自理能力。
在美国,大约有 650 万 65 岁及以上的人患有阿尔茨海默病。其中,超过 70% 为 75 岁及以上的人。在全球约 5500 万痴呆症患者中,估计 60% 至 70% 患有阿尔茨海默病。
这种疾病的早期症状包括忘记最近发生的事情或对话。随着时间的推移,它会发展成严重的记忆问题,并丧失执行日常任务的能力。
药物或许可以缓解症状或减缓症状进展。有各种项目和服务可以为该病患者及其照料者提供支持。
目前没有治疗方法可以治愈阿尔茨海默病。在晚期阶段,脑功能严重丧失可能引起脱水、营养不良或感染。这些并发症可能导致死亡。
症状
记忆丧失是阿尔茨海默病的主要症状。早期体征包括难以回忆起最近发生的事情或对话。随着病情的发展,记忆会恶化,其他症状也会出现。
阿尔茨海默病患者起初可能会意识到自己难以记起事情和清楚思考。随着症状恶化,家人或朋友可能更容易注意到这些问题。
与阿尔茨海默病相关的大脑变化会导致越来越多的问题:
记忆力
每个人都会偶尔出现短暂失忆,但与阿尔茨海默病有关的记忆丧失会持续存在并加重,逐渐影响工作和生活能力。
阿尔茨海默病患者可能:
- 不断重复同一句话或同一个问题。
- 忘记谈话、约会或事件。
- 把物品放错地方,经常把物品放在不合适的地方。
- 在他们曾经熟悉的地方迷路。
- 最终忘记家人姓名和日常品的名称。
- 难以使用正确的词语来描述物品、表达想法或参与谈话。
思考与推理
阿尔茨海默病会导致难以集中注意力和思考,尤其是对像数字这样的抽象概念。
同时做多项任务尤其困难。管理财务、计算开支和按时支付账单可能具有挑战性。最终,患有阿尔茨海默病的患者可能无法识别和处理数字。
做出判断和决定
阿尔茨海默病会导致在日常生活中做出合理决定和判断的能力下降。例如,患者可能在社交场合做出糟糕的选择,或者穿着不合时令的衣物。患者应对日常生活问题的能力可能下降。例如,患者可能不知道如何应对炉子上食物起火的情况,或在驾驶时难以做出判断。
计划和执行熟悉的任务
曾经按部就班的常规活动会变得十分困难,例如制定计划和做饭或玩喜欢的游戏。最终,病情严重的阿尔茨海默病患者会忘记如何完成一些基本任务,例如穿衣和浸浴。
性格和行为发生变化
阿尔茨海默病导致的大脑变化会影响情绪和行为。问题可能包括:
- 抑郁症。
- 对活动失去兴趣。
- 排斥社交。
- 情绪波动。
- 对他人不信任。
- 愤怒或攻击性。
- 睡眠习惯发生变化。
- 游荡。
- 丧失自制力。
- 幻想,例如认为有东西被偷了。
保留的技能
尽管阿尔茨海默病患者的记忆力和技能会发生重大变化,但即使症状恶化,其仍能掌握一些技能。这些技能可能包括阅读或听书、讲故事和分享回忆、唱歌、听音乐、跳舞、绘画或做手工。
这些技能之所以能保留更长时间,是因为控制这些技能的大脑部分在病程晚期才会受到影响。
何时就诊
多种状况都可能导致记忆丧失或其他痴呆症状。其中有些状况是可以治疗的。如果您对自己的记忆力或其他思维能力感到担忧,请咨询医疗护理专业人员。
如果您对在家人或朋友身上观察到的思维能力感到担忧,请说出您的担忧,并咨询医疗护理专业人员。
病因
健康大脑和阿尔茨海默病患者的大脑
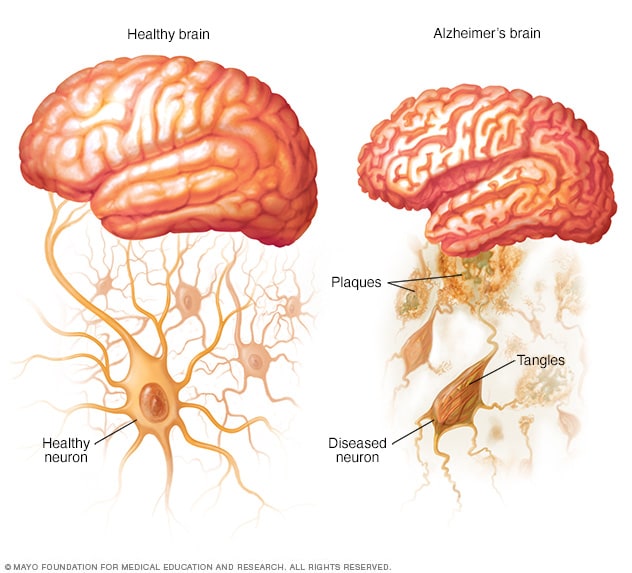
健康大脑和阿尔茨海默病患者的大脑
阿尔茨海默病患者的大脑中会形成淀粉样斑块,Tau 蛋白形状改变,并相互缠结。
阿尔茨海默病的确切原因尚不完全清楚。但从基本层面来说,是由于脑蛋白质无法正常运作。这扰乱了脑细胞(神经元)的工作,进而引发一系列事件。神经元受损,彼此失去连接能力,最终神经元死亡。
科学家认为,阿尔茨海默病是遗传、生活方式和环境因素共同作用的结果,这些因素会随着时间的推移影响大脑。特定的基因变异也会导致阿尔茨海默病,这种基因变异几乎决定了变异者将患上这一疾病,但这一因素的占比不到 1%。在这种病例中,症状通常从中年开始。
阿尔茨海默病其实在首发症状前几年就已开始发展。这类损伤通常始于负责控制记忆的大脑区域。神经元丢失会以某种可预测的模式扩散到大脑的其他区域。到了疾病晚期,大脑已经明显萎缩。
研究人员在试图了解阿尔茨海默病病因时主要专注于两种蛋白质的作用:
- 斑块。β-淀粉样蛋白是一种较大蛋白质的片段。这些片段一旦聚集成团块,似乎会对神经元产生毒性作用,破坏大脑细胞之间的通讯。团块形成的较大沉积物被称作淀粉样斑块,其中还含有其他细胞碎片。
- 缠结。Tau 蛋白在大脑细胞的内部支持和运输系统中发挥携带营养物质和其他必需物质的作用。在阿尔茨海默病患者体内,Tau 蛋白会改变形状,形成被称为神经原纤维缠结的结构。此缠结会破坏运输系统,对细胞造成损伤。
风险因素
年龄
年龄增长是阿尔茨海默病最大的已知风险因素。阿尔茨海默病并不是正常衰老的一部分。但随着年龄的增长,患这种疾病的几率会增加。
一项研究发现,每年每 1000 位 65 至 74 岁的老年人中有 4 例新确诊。每 1000 位 75 至 84 岁的老年人中有 32 例新确诊。每 1000 位 85 岁以上的老年人中有 76 例新确诊。
家族史和遗传
如果您的一级亲属(父母或兄弟姐妹)患有阿尔茨海默病,则您的患病风险较高。家族基因如何影响患病风险在很大程度上尚未得到解释,而且遗传因素可能很复杂。
得到较多了解的一个遗传因素是载脂蛋白 E(APOE)的一种基因分型。APOE e4 基因分型会增加患阿尔茨海默病的风险。APOE e4 携带者大约占人口的 25% 到 30%。但并非每个携带这种基因分型的人都会患病。
科学家们在三种基因中发现了罕见变化,几乎可以确定其遗传者将会患上阿尔茨海默病。但是这些变化在阿尔茨海默病患者中所占比例不足 1%。
唐氏综合征
很多唐氏综合征患者会发展出阿尔茨海默病。这可能与 3 个 21 号染色体拷贝有关,而 21 号染色体基因会参与生成形成 β 淀粉样蛋白的蛋白质。β 淀粉样蛋白片段可能会成为大脑中的斑块。唐氏综合征患者的症状往往比一般人群早出现 10 到 20 年。
性别
总体而言,女性患者稍多一些,因为她们的寿命通常比男性更长。
轻度认知损害
有些轻度认知损害(MCI)患者的记忆力或其他思维能力下降的严重程度高于同龄人的正常水平,但这种下降不会妨碍患者的社交或工作。
然而,MCI 患者有罹患痴呆症的显著风险。如果 MCI 主要影响记忆力,由于阿尔茨海默病的影响,该状况更有可能发展为痴呆症。诊断出 MCI 会带来机会,让患者更关注健康的生活方式变化,针对记忆丧失制订相关弥补策略。患者还可以定期安排医疗护理就诊,以监测症状。
头部创伤
几项大型研究发现,50 岁或以上患有创伤性脑损伤(TBI)的患者出现痴呆症和阿尔茨海默病的风险增加。严重和多发性 TBI 患者的风险更高。一些研究发现,在损伤发生后的头六个月至两年内,风险可能最大。
空气污染
动物研究表明,空气污染微粒会加速神经系统衰竭。而人类研究表明,暴露在空气污染中,尤其是交通尾气和木材燃烧污染,会增加患失智症的风险。
过度饮酒
人们早就知道大量饮酒会导致大脑发生变化。多项大型研究和综述发现,酒精使用障碍与痴呆症风险增加有关,尤其是早发性痴呆症。
糟糕的睡眠模式
研究表明,睡眠模式不佳,例如入睡困难或难以保持睡眠,与阿尔茨海默病的风险增加有关。
生活方式和心脏健康
研究表明,与心脏病相关的风险因素也可能增加患痴呆症的风险。目前还不清楚这些因素是通过加重脑内阿尔茨海默病异常还是通过引起脑血管异常来增加痴呆症的风险。其中包括:
- 缺乏运动。
- 肥胖症。
- 吸烟或接触二手烟。
- 高血压。
- 高胆固醇。
- 2 型糖尿病控制不佳。
这些因素都可以被改善。因此,改变生活方式可能在一定程度上改变您的患病风险。例如,定期运动和富含果蔬的健康低脂饮食有助于降低患阿尔茨海默病的风险。
终生学习和参与社会活动
研究发现,社交活动和参与生活中激发思维的活动可降低患阿尔茨海默病的风险。教育水平低(高中以下学历)似乎是一个与阿尔茨海默病相关的风险因素。
并发症
阿尔茨海默病的症状(如记忆丧失、语言丧失、判断力受损以及其他脑部病变)会使其他健康状况更难控制。阿尔茨海默病患者可能无法:
- 向别人诉说自己的疼痛。
- 说明另一种疾病的症状。
- 遵循治疗计划。
- 说明药物的副作用。
随着阿尔茨海默病进入到晚期,脑部变化开始影响身体功能。这些变化会影响到吞咽、平衡以及大小便的控制能力。这些影响可能会导致其他健康问题,例如:
- 肺部吸入食物或液体。
- 流感、肺炎和其他感染。
- 跌倒。
- 骨折。
- 褥疮。
- 营养不良和脱水。
- 便秘或腹泻。
- 口腔溃疡或龋齿等牙科问题。
预防
阿尔茨海默病不是可预防的医疗状况。但是,可以改变一些与生活方式有关的风险因素。
证据显示,采取降低心血管疾病风险的措施也可能降低患上失智症的风险。
以下有益心脏健康的生活方式可降低患失智症的风险:
- 定期锻炼。
- 采用以新鲜农产品、健康油脂为主且饱和脂肪含量低的饮食,例如地中海饮食。
- 按照治疗指导原则管理高血压、糖尿病和高胆固醇。
- 如果您吸烟,请向医疗护理专业人员寻求帮您戒烟的建议。
在芬兰进行的一项大型长期研究发现,改变生活方式有助于减轻失智症风险人群的认知能力下降。研究参与者接受了专注于饮食、锻炼和社交活动的个人和小组治疗。
在澳大利亚进行的另一项研究中,失智症风险人群接受了饮食、锻炼和其他生活方式改变方面的辅导。与未接受辅导的人相比,他们在一年、两年和三年后的认知测试中表现更佳。
其他研究表明,保持精神和社交活跃有助于在以后的生活中保持思维能力并降低患阿尔茨海默病的风险。这包括参加社交活动、解读、舞蹈、棋盘游戏、艺术创作、演奏乐器以及其他活动。